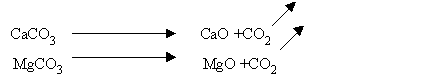
PRODUTOS UTILIZADOS PARA A CORREÇÃO
DA ACIDEZ DOS SOLOS
1. OS PRODUTOS
Os produtos considerados corretivos da acidez dos solos são aqueles que contêm como «constituinte neutralizante», ou «princípio ativo», carbonatos, óxidos, hidróxidos ou silicatos de cálcio e/ou de magnésio. Assim são corretivos de acidez:
Calcário moído: material existente com relativa freqüência e abundância, o que justifica o seu maior uso universalmente. Seus constituintes neutralizantes são o carbonato de cálcio (CaCO
3) e o carbonato de magnésio (MgCO3.). Em função do teor de (MgCO3) presente nos calcários estes são classificados em: calcíticos, quando o teor de (MgCO3 ) é baixo, não excedendo a 2-5% (ou 1 a 2,5% de MgO); magnesianos, quando o teor de (MgCO3) é de 5 a 20% (ou 2,5 a 10% de MgO); dolomíticos, quando o teor de (MgCO3) é maior do que 20% (ou 10% de MgO) (BOYNTON, 1966). Em geral os jazimentos calcários são de origem orgânica, de natureza sedimentar ou metamórfica;Cal virgem: produto obtido industrialmente pela calcinação ou queima do calcário; os seus constituintes neutralizantes são o óxido de cálcio (CaO) e o óxido de magnésio (MgO) e se apresenta, por natureza, como pó bastante fino:
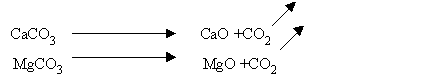
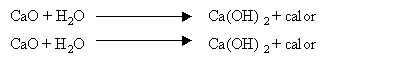
Outros materiais: margas (depósitos terrestres de carbonato de cálcio), calcários marinhos (corais, sambaquis) e subprodutos de diversas indústrias são também considerados corretivos de acidez.
É importante esclarecer que o gesso (CaSO
4 . 2H2O) não é corretivo de acidez mas corretivo de salinidade.2. AÇÃO NEUTRALIZANTE
A neutralização da acidez dos solos pelos corretivos de acidez é feita através da base química contida no constituinte neutralizante.
Os carbonatos e silicatos neutralizam a acidez através das suas bases CO
![]()

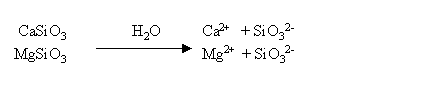
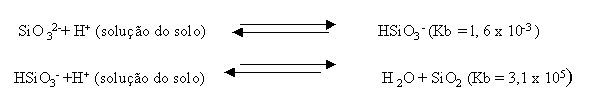
Os óxidos reagem instantaneamente com a água do solo transformando-se em hidróxidos.
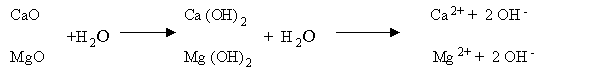
Assim, os óxidos e os hidróxidos neutralizam a acidez através da base OH-, que é forte e lhes confere uma causticidade característica.
![]()
Devido a essas características químicas, a reação dos óxidos e dos hidróxidos é muito mais rápida e enérgica do que a dos carbonatos e silicatos, mais lenta e suave. Do ponto de vista prático, essa reação rápida e altamente cáustica dos óxidos e hidróxidos pode trazer prejuízo à população microbiana do solo e à atividade dos microrganismos, com possibilidade até de esterilizar parcialmente o solo; se aplicados muito próximo da época de plantio podem induzir a uma
deficiência temporária de potássio devido ao alto teor de cálcio e, em casos extremos, podem causar retardamento no crescimento e até a morte das plantas (POTASH AND PHOSPHATE INSTITUTE, 1979). Por isso, as recomendações de doses devem ser mais cuidadosas e precisas. Além disso, são produtos de manuseio desagradável, devido à causticidade, e devem ser imediatamente e muito bem incorporados ao solo, caso contrário a umidade e o CO2 da atmosfera fazem com que se carbonatem e se empedrem, tornando-os ineficientes.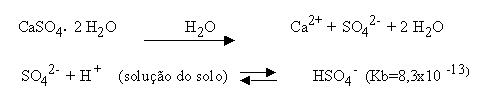
Observação: no caso do gesso, a base presente é SO
42-, fraquíssima, razão pela qual o gesso não é corretivo de acidez.
3. CAPACIDADE DE NEUTRALIZAÇÃO DOS CONSTITUINTES NEUTRALIZANTES
Os constituintes neutralizantes dos corretivos, por serem de natureza química diferente, apresentam diferentes capacidades de neutralização.
A neutralização da acidez do solo é uma reação química, e como tal, obedece o «princípio de equivalência», isto é, «numa reação química participam iguais números de equivalentes, tanto dos reagentes como dos produtos da reação». Assim, na neutralização da acidez do solo,
n equivalentes-grama de H+ serão neutralizados por n equivalentes-grama de constituinte neutralizante. Mas a quantidade de constituinte neutralizante correspondente a 1 equivalente-grama varia entre eles, conforme é apresentado na Tabela 1.Considerando uma igual quantidade de cada constituinte neutralizante, por exemplo 50 g, o número de equivalentes-grama contidos nessa quantidade difere entre os constituintes neutralizantes, conforme está calculado na Tabela 1. Esses valores correspondem à capacidade de neutralização relativa de cada constituinte neutralizante: a capacidade de neutralização do (MgCO
3) é 1,19 vezes a do (CaCO3), a capacidade de neutralização do (CaO) é 1,79 vezes a do (CaCO3) e a capacidade de neutralização do (MgSiO3) é igual à do (CaCO3). O (MgO) é o constituinte de maior capacidade de neutralização e o (CaSiO3) o de menor capacidade. Esses valores constituem a «equivalência em carbonato de cálcio - E CaCO3» dos diferentes constituintes neutralizantes.Ao se expressar o teor de neutralizantes de um corretivo em função dos seus constituintes, por exemplo, 85% de (CaCO
3) ou 52% de (CaO) ou 75% de (MgSiO3), nada está sendo considerado sobre a capacidade de neutralização deles.A fim de que o teor de neutralizantes mostre essa capacidade de neutralização, é expresso em equivalente em carbonato de cálcio, que é tomado como padrão. Assim, com base na equivalência em carbonato de cálcio dos diferentes constituintes, o teor equivalente em carbonato de cálcio de um corretivo (% E CaCO
3) pode ser calculado da maneira apresentada na Tabela 2.TABELA 1. Equivalente em carbonato de cálcio E(CaCO
3) dos diferentes constituintes neutralizantes dos corretivos.| CONSTITUINTES |
FÓRMULAS |
MASSA (g) de 1 e. g* |
Número de e. g* em 50 g E(CaCO3) |
||
| Carbonato de cálcio | CaCO 3 |
50,00 |
1,00 |
||
| Carbonato de magnésio | MgCO 3 |
42,16 |
1,19 |
||
| Hidróxido de cálcio | Ca(OH) 2 |
37,05 |
1,35 |
||
| Hidróxido de magnésio | Mg(OH) 2 |
29,16 |
1,72 |
||
| Óxido de cálcio | CaO |
28,04 |
1,79 |
||
| Óxido de magnésio | MgO |
20,16 |
2,48 |
||
| Silicato de cálcio | CaSiO 3 |
58,08 |
0,86 |
||
| Silicato de magnésio | MgSiO 3 |
50,20 |
1,00 |
(*) equivalente - grama
4. GRANULOMETRIA OU TAMANHO DAS PARTÍCULAS
A solubilidade em água dos constituintes neutralizantes dos corretivos é baixa: CaCO
3 - 0,014 g/l a 250C; MgCO3 - 0,106 g/l a 250C; Ca(OH) 2 - 1,85 g/l a 00C; Mg(OH) 2 - 0,009 g/l a 180C; CaSiO3 - 0,095 g/l a 170C (WEAST, 1969); o CaO e o MgO reagem com a água produzindo os respectivos hidróxidos. As impurezas presentes nos materiais corretivos concorrem para dificultar a solubilidade desses constituintes.TABELA 2. - Conversão dos teores de constituintes neutralizantes de corretivos, em teor equivalente em carbonato de cálcio
( % E (CaCO3))Teores de constituintes Neutralizantes nos corretivos |
E (CaCO 3) ( % ) |
(1) 62,1% de CaCO 3 e 21,7% de MgCO3 |
62,1 x 1, 00 + 21,70 x 1,19 = 87.9 |
(2) 24,7% de CaO e 16,3% de MgO |
24,7 x 1,79 + 16,30 x 2,48 = 84,6 |
(3) 35,2% de CaO e 5,8% de MgO |
35.2 x 1,79 + 5,80 x 2,48 = 77,4 |
(4) 50,1% de CaO e 20,5% de MgO |
50,1 x 1,79 + 20,50 x 2,48 = 140,5 |
(5) 75,0% de CaO e 1,1% de MgO |
75.0 x 1,79 + 1,10 x 2,48 = 137,0 |
(6) 47,5% de Ca(OH) 2 e 25,5% de Mg(OH) 2 |
47,5 x 1,35 + 25,50 x 1,72 = 108.0 |
(7) 58,9% de CaSiO 3 e 23,6% de MgSiO3 |
58,9 x 0,86 + 23,60 x 1,00 = 74,3 |
Por isso, a ação dos corretivos no solo depende, além da umidade, do contato corretivo-solo. Sabe-se que a subdivisão de um material aumenta sua superfície total de exposição, possibilitando maior área de contato. Portanto, quanto mais fino for o corretivo, mais rápida será sua ação na correção da acidez e vice-versa.
5. REATIVIDADE E EFEITO RESIDUAL - EFICIÊNCIA
A prática da calagem tem se fundamentado em duas características dos corretivos: reatividade e efeito residual.
Reatividade de um corretivo é a sua velocidade de ação no solo, o que é traduzido na rapidez com que a acidez é corrigida. A reatividade dos corretivos depende de vários fatores:
—
da natureza química dos neutralizantes: conforme já referido, os óxidos e os hidróxidos são muito mais reativos do que os carbonatos e silicatos;—
da granulometria: conforme já referido, quanto mais fino for o corretivo, maior sua reatividade;—
de condições de solo e de clima: quanto maior for a acidez do solo, a temperatura e a umidade, maior a reatividade, razão pela qual nas regiões tropicais os corretivos são mais reativos do que nas regiões temperadas (SÁNCHEZ & SALINAS, 1983).É importante lembrar que os corretivos mais reativos são, em geral, de custo mais elevado, porque necessitam de moagem mais intensa ou calcinação ou ambos.
Efeito residual de um corretivo é o tempo de duração da calagem efetuada. É considerado um fator primordial no manejo dos solos ácidos e principalmente na economicidade da calagem (SANCHEZ & SALINAS, 1983; MIELNICZUK, 1983; VAN RAIJ & QUAGGIO, 1984), conforme evidencia a Tabela 3.
TABELA 3. Balanço econômico do efeito da aplicação de calcário em três culturas. Preparado com dados de Camargo et alii (1982), Silva et alii (1980) e Van Raij et alii (1977), citados por VAN RAIJ & QUAGGIO (1984).
Calcário aplicado |
Custo do Calcário |
Aumento da produção devido a calagem |
Relação retorno / Investimento |
||
no 10 ano |
em termos de produto |
No 10 ano |
No período considerado |
No 10 ano |
No período Considerado |
(t/ha) |
(kg/ha) |
(kg/ha) |
|||
Cinco anos de cultivo de milho, em Mococa (SP) |
|||||
3 |
360 |
422 |
7.677 |
1,2 |
21,2 |
6 |
720 |
600 |
11.619 |
0,8 |
16,1 |
9 |
1080 |
1.250 |
13.777 |
1,2 |
12,8 |
Quatro anos de cultivo de algodão em Guaíra (SP) |
|||||
1,3 |
60 |
32 |
1.072 |
0,5 |
17,9 |
3,0 |
120 |
245 |
2.609 |
2,0 |
21,7 |
6,0 |
240 |
442 |
4.092 |
1,8 |
17,1 |
Três anos de cultivo de soja, em São Simão (SP) |
|||||
1,5 |
150 |
473 |
1.746 |
3,2 |
11,6 |
3,0 |
300 |
513 |
2.357 |
1,7 |
7,9 |
4,5 |
450 |
645 |
2.610 |
1,4 |
5,8 |
Essas duas características dos corretivos são antagônicas, isto é, quanto maior a reatividade menor o efeito residual e vice-versa. TISDALE & NELSON (1975), afirmam textualmente: «os materiais finamente divididos reagem rapidamente no solo, mas seu efeito é mantido por um período mais curto do que os materiais que contêm uma razoável quantidade de partículas mais grossas». O mesmo foi confirmado recentemente por BARROS et alii (1985) nas condições brasileiras.
A eficiência de um corretivo está indiscutivelmente ligada ao lucro proporcionado ao agricultor. Assim, qual o corretivo mais eficiente? O mais reativo, que tem uma ação mais rápida, apesar do baixo efeito residual e de ser mais caro? O de maior efeito residual, de ação mais lenta, mas de efeito mais prolongado e de custo mais baixo?
Nem a prática e nem a pesquisa conseguiram reunir dados suficientes que possibilitem uma indicação mais precisa. A hipótese mais viável é a de que, apesar de existirem situações em que aqueles dois extremos sejam necessários, ou seja, o de maior reatividade ou de maior efeito residual, a grande maioria dos casos necessita de corretivo dotado dessas duas características em níveis intermediários e que, portanto, devem ser os mais eficientes economicamente.
6. QUALIDADE E AVALIAÇÃO
Dentre as diversas características dos corretivos da acidez dos solos, duas são as que têm sido relacionadas com a qualidade desses o teor de neutralizantes e o tamanho das partículas ou granulometria.
6. 1. Teor de neutralizantes.
A avaliação do teor de neutralizantes dos corretivos é feita através das determinações químicas do poder de neutralização (PN) e dos teores de cálcio e de magnésio.
O poder de neutralização indica a capacidade potencial do corretivo em neutralizar a acidez do solo e sua determinação fundamenta-se em fazer uma amostra do corretivo reagir com uma quantidade conhecida e em excesso de solução de ácido clorídrico diluído (0,5 N); assim, é dada oportunidade ao corretivo de exercer toda a sua capacidade de neutralizar o ácido. Determinando-se o excesso de ácido, por diferença calcula-se a quantidade de ácido neutralizada pelo corretivo; de acordo com o princípio da equivalência, equivale à quantidade de constituintes neutralizantes contidos no corretivo. Os constituintes neutralizantes podem ser diversos, mas considera-se ou supõe-se que seja o CaCO
3, que é tomado como padrão, e calcula-se a quantidade de CaCO3 que deveria estar contida na amostra para neutralizar aquela quantidade de ácido e o resultado é expresso porcentualmente em «equivalente em CaCO3» % E(CaCO3). Como se observa, essa determinação não indica a natureza química do neutralizante presente (carbonato, óxido, hidróxido ou silicato).Na categoria de corretivos agrícolas exige-se que os neutralizantes estejam associados ao cálcio e/ou magnésio, devido a estes constituírem-se em macronutrientes vegetais. Isso significa que, por exemplo, carbonato de sódio (Na
2CO3), óxido de bário (BaO), hidróxido de sódio (NaOH), silicato de bário (BaSiO3), apesar de serem neutralizantes de acidez, não se enquadram como corretivos agrícolas. Por isso é que o cálcio e o magnésio também precisam ser determinados, e essa determinação é feita digerindo-se energicamente uma amostra do corretivo com solução de ácido clorídrico concentrado, solubilizando assim todo o cálcio e o magnésio, que são posteriormente determinados. O resultado real obtido é do teor total dos elementos cálcio e magnésio, mas que, por convenção, é expresso na forma de óxido, CaO e MgO, independente da natureza química dos constituintes presentes.Assim, na avaliação do teor de neutralizantes tem-se o percentual de neutralizantes expresso em equivalente em carbonato de cálcio %E(CaCO
3) e os teores de cálcio e de magnésio expressos na forma de óxidos, (% CaO e % MgO, respectivamente). Isso não permite caracterizar a classe do corretivo, isto é, se é calcário, cal virgem, cal hidratada ou silicato.Observação: nos corretivos pode-se ter dois valores para o % E(CaCO
3): um proveniente da determinação do PN e outro calculado dos teores de óxido de cálcio e de magnésio, isto é:![]()
Teoricamente esses valores deveriam ser iguais mas, na prática, podem ser até bastante diferentes, conforme mostra a Tabela 4; isso é justificado principalmente pelas formas diferentes de ataque da amostra nas determinações do PN e do CaO e MgO: no primeiro o ataque é suave ou brando pois utiliza solução relativamente diluída (0,5 N) de HCl, e no segundo o ataque é enérgico, utilizando solução concentrada (12 N) de HCl. Assim, o valor do % E(CaCO
3), obtido na determinação do PN é geralmente menor do que o obtido dos teores de CaO e MgO; a grandeza da diferença depende da natureza e da granulometria do material.TABELA 4. Valores do equivalente em carbonato de cálcio (%CaCO
3), (A) obtidos pela determinação do poder de neutralização (PN) e (B) calculados através dos teores de óxidos de cálcio (CaO) e de magnésio (MgO).% E(CaCO 3) |
% E(CaCO 3) |
||||||
Amostras |
A |
B |
Amostras |
A |
B |
||
% |
% |
% |
% |
||||
1 |
107,6 |
107,7 |
6 |
53,9 |
76,7 |
||
2 |
77,1 |
85,7 |
7 |
54,6 |
75,7 |
||
3 |
88,1 |
91,7 |
8 |
95,0 |
98,2 |
||
4 |
69,7 |
83,2 |
9 |
76,7 |
80,7 |
||
5 |
98,2 |
99,0 |
10 |
84,7 |
85,2 |
||
A legislação brasileira em vigor (BRASIL, 1983) exige que os corretivos apresentem, no mínimo, 67% E(CaCO
3) de PN, com tolerância para menos em até 20% da garantia, e no mínimo, 38% na soma dos teores de óxidos de cálcio e de magnésio, com tolerância para menos em até 10% da garantia da soma, sem exceder a 20% da garantia de óxido de magnésio.À primeira vista, pode-se inferir que quanto maior o teor de neutralizantes, ou seja, o % E(CaCO
3), de um corretivo, melhor a sua qualidade. Isso pode ser válido dentro de cada classe de corretivo; mas sua generalização é incorreta, devido às diversas classes apresentarem características físicas e químicas diferentes e relacionadas com a qualidade, conforme já considerado. Assim não fosse, poderia se sugerir que todo o calcário fosse calcinado, transformando os carbonatos em óxidos, com capacidade de neutralização bastante superior.Além disso ainda, na prática o teor de neutralizantes dos corretivos relaciona-se diretamente com a quantidade a ser aplicada, isto é, quanto maior o teor, menor a quantidade necessária. Isto, porém, deve ser considerado sob dois aspectos: o econômico e o técnico. No aspecto econômico, devido ao alto custo do transporte, que comumente chega a ser superior ao custo do corretivo, produtos com altos teores de neutralizantes vêm atraindo sobremaneira os consumidores, apesar de serem mais caros, pois, no momento, o balanço econômico tem sido positivo em muitos casos. No aspecto técnico, o uso de menores quantidades pode comprometer a uniformidade da distribuição e, conseqüentemente, da correção da acidez.
6. 2. Tamanho das partículas ou granulometria.
A avaliação da granulometria dos corretivos é feita através da análise granulométrica, que consiste no peneiramento mecânico da amostra, utilizando peneiras com aberturas de malhas especificadas.
No Brasil, a exigência granulométrica oficial foi, durante muito tempo, a de que os corretivos devem passar 100% na peneira n.0 10 (ABNT - 2,00 mm) e, no mínimo, 50% na peneira n0 50 (ABNT -
0,300 mm) (BRASIL, 1961 e 1975); atualmente, a legislação estabelece que devem passar 95% na peneira n.0 10 (ABNT - 2,00 mm), com tolerância de 5%, e no mínimo 50% na peneira n.0 50 (ABNT - 0,300 mm) (BRASIL, 1983).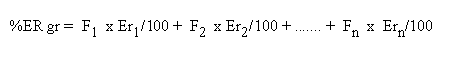
A partir da composição granulométrica pode-se avaliar a eficiência relativa granulométrica (ER gr) pela expressão: onde,
F
1, F2, ... Fn = percentual das diversas frações granulométricas.Er
1,Er2, ... Ern = taxas porcentuais de eficiência relativa das respectivas frações granulométricas.A validade dessa avaliação está fundamentada nas taxas de eficiência das diferentes frações granulométricas (Er
11, Er2, ... Ern). No Brasil, inicialmente foram utilizadas as taxas adotadas no Estado de Ohio (EUA), que consideram um efeito residual de 3 anos; posteriormente VAN RAIJ (1977) e BELLINGIERI (1982) estimaram essas taxas, em experimentos de casa de vegetação que duraram 18 e 3 meses, respectivamente. Os diferentes valores para essas taxas estão apresentados na Tabela 5.TABELA 5. Taxas de «eficiência relativa» para as frações granulométricas dos diferentes corretivos.
Fração granulométrica (em no peneira) |
Taxas de <<eficiência relativa>> (*) A B C |
||||
Retida na 10 |
0 |
0 |
0 |
||
10 - 20 |
20 |
- |
- |
||
10 - 30 |
- |
- |
35 |
||
10 - 50 |
- |
40 |
- |
||
20 - 60 |
60 |
- |
- |
||
30 - 50 |
- |
- |
75 |
||
Passa a 50 |
- |
100 |
100 |
||
Passa a 60 |
100 |
- |
- |
||
(*)
A: adotadas em Ohio (USA); B: estimadas por VAN RAIJ (1977);C: estimadas por BELLINGIERI (1982).
Contudo, é importante notar que as taxas estimadas no Brasil não se caracterizam como taxas de eficiência, mas como taxas de reatividade por não considerarem devidamente o fator efeito residual. Assim, o uso dessas taxas tem resultado propriamente numa avaliação da reatividade relativa granulométrica (%RR gr) dos corretivos.
![]()
onde, F
1, F2, ... Fn = percentual das diversas frações granulométricas.Rr
1, Rr2, ... Rrn = taxas porcentuais de reatividade relativa das respectivas frações granulométricas.Parece evidente que, no Brasil, os corretivos estão sendo qualificados apenas pela reatividade, o que explica o enaltecimento e o interesse que vem sendo dado aos produtos de granulometria fina, como as cales, os calcários calcinados e os calcários «filler» (calcários de granulometria bastante fina), mas sem ainda uma adequada justificativa técnica e nem econômica. E isso pode estar induzindo os produtores a colocarem no comércio apenas os produtos de granulometria fina, o que para a maioria deles, só será conseguido através de acentuadas e onerosas modificações nas instalações industriais (secadores, moinhos mais aperfeiçoados, ensacamento), que certamente irão encarecer o produto, sem ainda o aval da experimentação agrícola.
Além disso, os produtos de granulometria fina apresentam maiores problemas na aplicação: aglutinação das partículas, aderência nas paredes dos depósitos dos equipamentos aplicadores, fluidez ou descarga irregular prejudicando a uniformidade da distribuição, assim como, e principalmente, perdas acentuadas devido ao vento.
Não se pode deixar de mencionar a técnica da «calagem no sulco», surgida recentemente e que objetiva facilitar e economizar na calagem, aproveitando a maior reatividade dos produtos de granulometria bastante fina. Os resultados de produção, porém, têm sido sempre inferiores aos obtidos com a calagem tradicional.
6. 3. Poder Relativo de Neutralização Total (PRNT).
Foi visto que através da determinação do poder de neutralização (PN) obtém-se o teor total de neutralizantes de um corretivo, ou seja, a sua capacidade potencial em corrigir a acidez. O desempenho efetivo dessa capacidade depende basicamente da sua composição granulométrica; por isso, desenvolveu-se a avaliação da eficiência granulométrica.
Mesmo dispondo-se dessas duas avaliações, separadamente, ainda fica difícil avaliar a qualidade de um corretivo como um todo. Essa dificuldade conduziu à idealização de um índice que aglutinasse essas duas características de qualidade e permitisse quantificar conjuntamente, num único valor, essas duas avaliações: esse índice é o Poder Relativo de Neutralização Total (PRNT), o qual é obtido pela expressão:
![]()
![]()
, onde :
% Er gr = eficiência relativa granulométrica.
A importância desse índice é inestimável para a prática da calagem, uma vez que permite ajustar a quantidade de corretivo recomendada à qualidade dos produtos disponíveis. Contudo, o uso desse índice, no Brasil, fica comprometido devido à incorreta estimativa da eficiência relativa granulométrica utilizada, considerando a reatividade relativa granulométrica (Rr gr) como eficiência, isto é:
![]()
O PRNT obtido por essa expressão, e considerado como indicador de qualidade, tem fomentado a calcinação dos calcários: com isso aumenta-se, concomitantemente, o teor de neutralizantes E(CaCO3) e a reatividade (o produto resultante é facilmente moído a pó fino), elevando-se consequentemente o valor do PRNT; inclusive provoca o interesse na calcinação total dos calcários, visando máximos valores de PRNT. Por outro lado, como o valor do PRNT pode ser elevado aumentando-se apenas a reatividade, tem-se atribuído também melhor qualidade a calcários extremamente finos (calcário «filler»).
São precisamente esses questionamentos relativos à eficiência granulométrica dos corretivos que têm impedido a oficialização do índice PRNT pela legislação brasileira, apesar da sua indiscutível utilidade e da pressão exercida sobre o Ministério da Agricultura, tanto por parte de produtores como de consumidores e de técnicos e pesquisadores agrícolas.
7. CONCLUSÃO
As pesquisas desenvolvidas no Brasil sobre a qualidade dos corretivos da acidez do solo são reduzidas, razão porque o critério oficial de avaliação desses insumos deixa muito a desejar.
Essa carência, associada à importância e ao tamanho da necessidade de corretivos pela agricultura brasileira, e principalmente às dificuldades econômicas em atendê-las, tem motivado a avaliação dos corretivos através de uma característica cuja relação com a qualidade é apenas parcial: a reatividade, tanto de natureza química como granulométrica. Essa característica, desvinculada do efeito residual, que é de fundamental importância na prática da calagem, não deve refletir a eficiência de um corretivo. Sua incorreta utilização na avaliação dos corretivos através do índice PRNT, largamente difundido, está comprometendo a real qualificação desses materiais.
A teoria e a prática da calagem dão fortes indicações de que a elevação arbitrária e ilimitada do PRNT dos calcários, quer pela calcinação, quer pela moagem mais fina ou ambas, não é justificável, nem técnica e nem economicamente. Estudos urgentes são reclamados, pois essa imprecisão seguramente está prejudicando os produtores de corretivos, os agricultores e a agricultura brasileira.
INFORMAÇÕES AGRONÔMICAS No 34 - Junho de 1986 - POTAFOS
(*) Prof. Assistente, Doutor. Escola Superior de Agricultura Luiz de Queiroz, (USP). Departamento de Química. Piracicaba (SP).
8. LITERATURA CITADA
BARROS, U. V.; FIGUEIREDO, J. P.; SANTINATO, R.; SILVA, O. A. Estudo comparativo do calcário dolomítico e do calcário calcinado no plantio do cafeeiro em solo LVA de cerrado. In: CONGRESSO BRASILEIRO DE PESQUISAS CAFEEIRAS, 12., 1985. Anais. Rio de Janeiro, IBC/GERCA, 1985. p. 105-6.
BELLINGIERI, P. A. Avaliação, em laboratório, da eficiência relativa de diferentes frações granulométricas de calcários, na neutralização da acidez dos solos. Piracicaba, 1982. 99 p. (Doutoramento
BOYNTON, R. 5. Chemistry and technology of limestone. New York, Inter Science, 1966. 520 p.
BRASIL. Decreto n? 50.146 de 27 jan. 1961. Departamento de Produção Vegetal, Ministério da Agricultura, Rio de Janeiro, 1961.
BRASIL. Decreto n.0 75.583 de 09 abr. 1975. Divisão de Corretivos e Fertilizantes, Departamento Nacional de Produção Vegetal, Ministério da Agricultura, Brasília, 1975.
BRASIL. Portaria n.0 01 de 04 mar. 1983. Ministério da Agricultura, Brasília, 1983.
GOMES, A. G.; GARGANTINI, H.; BLANCO, H.G.
Comportamento de tipos de escórias de siderurgia como corretivo da acidez do solo. Bragantia, Campinas. 24(15):173-9, 1965.
GOMES, A. G.; GARGANTINI, H.; GUIMARÃES, G.; WUTKE, A. C. P. Competição entre materiais corretivos (escórias de siderurgia x calcários) em solos de várzea do Vale do Paraíba. Bragantia, Campinas, 21 (44) :777-93, 1962.
MIELNICZUK,
J. Economicidade da calagem. In: REUNIÃO BRASILEIRA DE FERTILIDADE DO SOLO, 15., Campinas, 1983. Resumos. Campinas, 1983. p. 63-77.POTASH AND PHOSPHATE INSTITUTE. Soil fertility manual. Atlanta, 1979. 88 p.
SÁNCHEZ, P. A. & SALINAS,
J. G. Suelos acidos. Bogotá, Sociedad Colombiana de la Ciencia del Suelo, 1983. 93 p.TISDALE, 5. L. & NELSON, W. L. Soil fertility and fertilizers. 3. ed. New York, Macmillan, 1975. 694 p.
VAN RAIJ, B. Estudo de materiais calcários usados como corretivos do solo no Estado de São Paulo.
IV. O poder relativo de neutralização total. Bragantia, Campinas, 36(12): 139-45, 1977.
VAN RAIJ, B. & QUAGGIO,
J. A. Uso eficiente de calcário e gesso na agricultura. In: SIMPÓSIO SOBRE FERTI LIZANTES NA AGRICULTURA BRASILEIRA, 1984. Anais. Brasilia, EMBRAPA, 1984. p. 323-46.WEAST, R. C. Handbook of chemistry and physics. The Chemical Rubber Co., 1969.
WUTKE, A. C. P. & GARGANTINI, 11. Avaliação das possibilidades de escórias de siderurgia como corretivos da acidez do solo. Bragantia, Campinas, 21(46) :795-805, 1962.