|
CORRETIVOS DE SOLOS – parte 1 |
CARACTERIZAÇÃO DA ACIDEZ DO SOLO E SUA NEUTRALIZAÇÃO
1.
A Acidez e os Solos Cultivados
A
acidez do solo é um fator importante a ser considerado, quando se tem por
objetivo a implantação de práticas agrícolas, tenham
elas a finalidade de proporcionar o lazer das pessoas (jardins, parques,
praças, etc.) ou sejam elas destinadas a atividades economicamente atraentes
(produção de flores, frutas, grãos, verduras, legumes e proteínas de origem
animal, etc.). Cada uma destas atividades agronômicas acima relacionadas, esta
sustentada por espécies vegetais, que apresentam necessidades específicas nos
solos dos terrenos onde são cultivadas. Dentre estas condições encontra-se a
acidez do solo.
A
definição dos limites de acidez, nos quais o pleno desenvolvimento das espécies
vegetais tem oportunidade de ocorrer, é de vital importância para a eleição dos
locais onde as culturas podem ser implantadas. O conhecimento destes limites
também é uma ferramenta importante para fundamentar as tomadas de decisão que
tenham por finalidade tornar o terreno mais propício para o plantio destas
culturas. A parametrização destes limites pode ser definida através de
avaliações, cuja finalidade específica reside em estabelecer intervalos de
acidez, onde cada espécie vegetal encontre condições para expressar a sua
máxima capacidade produtiva.
Tais
avaliações são conduzidas a campo ou em qualquer outro ambiente controlado.
Para dar forma a estes procedimentos são utilizados procedimentos experimentais
de uso cotidiano em agricultura. Nestas avaliações são utilizados produtos
corretivos em diferentes dosagens, tendo como objetivo criar diferentes
condições de acidez nos solos. Ao interferir na acidez original, são criados
diferentes níveis de acidez nos solos
destes locais, onde o trabalho é conduzido. Através destes procedimentos
experimentais pode-se então, definir os parâmetros de acidez, dentro dos quais
as espécies encontram as melhores condições para crescerem vigorosamente.
As
medidas de acidez dos solos, para a definição dos intervalos mais adequados
para o crescimento das espécies vegetais, são obtidas procedendo-se a análises
químicas em amostras de solos, coletadas nos locais onde são conduzidos estes
testes experimentais. Estas análises químicas mostrarão em que posição da
escala de acidez do solo a cultura avaliada apresenta o melhor desempenho
vegetativo e qual o nível de viabilidade da produtividade obtida, avaliado dentro
de padrões economicamente sustentáveis.
|
1. 1. Avaliação da Acidez nos Solos Cultivados |
Quando
se tem como propósito conhecer as características químicas dos terrenos
cultivados, dentre elas a sua acidez, realizam-se coletas de amostras de solos
destes locais, seguindo procedimentos específicos e bem definidos para cada
tipo de cultura. Esta amostragem de solo nos terrenos cultivados ocorre
costumeiramente entre 0 e 20cm de profundidade. Contudo, essa
porção do solo apresenta sempre teores mais elevados de elementos químicos e
assim melhores condições nutricionais para as plantas. Esta maior concentração
nesta profundidade do perfil do solo é decorrência de uma maior intensidade de
atividade biológica na decomposição biológica dos restos vegetais. Por isso,
encontra-se neste local uma maior concentração de raízes e uma exploração mais
intensa do sistema radicular das plantas. Entretanto, algumas culturas
apresentam demandas diferenciadas por maiores quantidades de água ou de
nutrientes. Nestas condições, pode ser necessário um maior aprofundamento do
sistema radicular das plantas, de tal forma que a suas necessidades
nutricionais possam ser mais bem atendidas. Quando maiores volumes de solo
ficam sob exploração das plantas ou o ciclo da cultura plantada é mais longo,
promovendo demandas nutricionais mais intensas, recomenda-se que a profundidade
de coleta de amostras de solo seja aprofundada, ficando entre 0 e 30cm.
O
acréscimo de um solo mais pobre na composição da amostra (próximo ao horizonte
B, é comum menores concentrações de elementos químicos), faz com que o seu
conteúdo em elementos químicos fique mais diluído. Isto permite a realização de
recomendações mais equilibradas para as necessidades de tais culturas, já que
cada espécie cultivada tem um comportamento vegetativo próprio, com
necessidades nutricionais muito particulares.
Algumas
regiões destinadas à agricultura apresentam solos com características adversas
para o desenvolvimento das plantas, fruto de condições químicas inadequadas
para o crescimento das raízes nos horizontes imediatamente abaixo da camada
arável. Quando isto acontece e tem-se como propósito corrigir estas outras
deficiências do solo, as amostras devem ser coletadas nestes horizontes com
maiores profundidades. A utilização do gesso, como alternativa para corrigir o
efeito negativo do alumínio em profundidade é uma destas indicações. Para que
esta prática seja aplicada, torna-se necessário que as análises químicas sejam
realizadas em amostras de solo coletadas na profundidade de 20-40cm (ou
na profundidade de 30-60cm, quando a amostras superficial for coletada
na profundidade de 0-30cm).
A
correção dos solos pode ser realizada com uma grande gama de produtos, atuando
como corretivos de solo, porém os principais veículos para essa prática são os
produtos derivados de rochas calcárias. São produtos que apresentam grande
dispersão pelos diferentes territórios e são abundantemente encontrados na
natureza. A utilização de gesso dá-se como condicionador de solos ou corretivo
de salinidade. Não se caracteriza como um corretivo de acidez de solo. Sua
utilização consiste numa prática confinada a determinadas regiões agrícolas e é
adotada em função das características dos solos nelas encontrados. A principal
fonte utilizada para essa finalidade é o gesso agrícola, que consiste num
resíduo produzido como subproduto da fabricação de adubos fosfatados. Sua
aplicação tem como propósito atuar nos horizontes mais profundos dos solos,
tendo como objetivo reduzir a atividade danosa do alumínio, especialmente em
solos álicos.
|
2. Relações da Acidez do Solo com os Ambientes de Produção |
A
acidez da solução do solo constitui-se no fator de maior importância para o
crescimento das plantas, sejam elas cultivadas ou não. No ambiente natural as
plantas adaptam-se e promovem um desenvolvimento possível. Essa é a razão pela
qual a vegetação natural apresenta-se com grande diversidade nas diferentes
regiões edafo-climáticas onde elas crescem.
Quando
a civilização chega a esses ambientes naturais em busca de alimentos, torna-se
necessário adaptá-los às condições das culturas que os homens utilizam para a
sua alimentação. Essas culturas, utilizadas principalmente para a produção de
alimentos, foram desenvolvidas em condições ideais de acidez e disponibilidade
de nutrientes nos solos. Assim, para apresentarem um bom desempenho em relação
à produtividade precisam de condições que reproduzam, com alguma proximidade,
as condições das regiões onde tiveram sua origem ou formas melhoradas. Na
medida em que a acidez constitui-se num fator restritivo ao crescimento dessas
culturas, o ambiente precisa ser alterado para adaptar-se a essa nova
exploração.
A
utilização de corretivos de acidez (calcários) e corretivos de salinidade ou
condicionadores de solos (gesso) nestes novos locais, ou mesmo em áreas onde
habitualmente já se fazem presentes estas práticas de agricultura, têm como
finalidade adequar o meio para que as plantas consigam manifestar os seus
melhores potenciais produtivos. A criação de um ambiente de produção favorável
também possibilita uma maior eficiência dos adubos minerais aplicados ao solo,
possibilitando melhores colheitas e conseqüentemente menores custos de produção
para os produtos agrícolas.
Manter
continuamente um ambiente favorável para o crescimento das plantas, implica
estar em constante atenção com as condições apresentadas pelos solos. Isto
significa, que criar condições adequadas nos solos cultivados, demanda manter
um criterioso monitoramento da sua acidez. A manutenção de níveis satisfatórios
de acidez é obtida através de aplicações de corretivos, sempre que os dados
analíticos dos solos mostrarem ser esta uma necessidade.
A
ação dos mesmos no solo contribuirá para reduzir as ações restritivas de
elementos que apresentam interferência negativa sobre o crescimento do sistema
radicular das plantas cultivadas. A eliminação de tais restrições possibilitará
um maior volume de solo explorado pelas raízes. Isso fará com que os nutrientes
fundamentais para o metabolismo das plantas, disponibilizados a partir do
ajuste adequado da acidez do solo, sejam mais eficientemente absorvidos e
transformados pelas plantas cultivadas.
|
2.1. Processo de Formação da Acidez nos Solos |
Na
ausência da interferência do homem, a acidez é um processo de ocorrência
natural e intrínseca do solo, podendo originar-se de reações de componentes do
ar reagindo com a água do solo, das atividades dos microrganismos na
decomposição dos restos orgânicos, de reações de troca de hidrogênio liberados
pelas raízes durante o processo metabólico da planta, da dissociação de
radicais orgânicos e de radicais OH- sacados dos minerais de argila.
A acidez também pode ser alterada de forma artificial e externa, através da
utilização de fertilizantes em cuja composição encontram-se sulfatos e
fosfatos.
A
principal fonte de hidrogênio dos solos são conseqüências das reações de
dissolução do CO2 da atmosfera e da fase
gasosa do solo com a água (das chuvas ou da solução), dando origem a moléculas
de ácido carbônico (H2CO3). A
dissociação deste ácido no solo promove um contínuo suprimento de íons H+
na solução do solo, conforme mostrado a seguir:
|
CO2 + H2O = H2CO3 = H+ + HCO3- |
Na
falta de cátions básicos, perdidos por lixiviação, os pontos com cargas
negativas dos colóides são progressivamente ocupados pelos íons H+.
Neste meio ácido, os compostos de alumínio reagem dando origem ao alumínio
trocável (Al+3). Enquanto o meio assim permanecer
e o pH mantiver-se ácido o alumínio será o cátion predominante no complexo de
trocas, competindo por pontos com cargas negativas dos colóides que poderiam
ser ocupadas por cátions importantes para a nutrição das plantas. Este processo
promove a efetivação da parte desfavorável da acidez sobre o crescimento dos
vegetais.
|
2.2. Conceito de Acidez |
Um
solo, cuja solução apresente um valor de pH abaixo de 7,0, pode ser considerado
um solo ácido. Contudo, do ponto de vista agronômico, para constituir-se numa
limitação para o uso agrícola, tais valores de pH devem apresentar-se abaixo de
valores que efetivamente prejudiquem o crescimento das plantas.
A
acidez dos solos pode ter diferentes origens na dinâmica do comportamento
constituintes dos solos. Independentemente de suas fontes de origem, a acidez é
costumeiramente classificada em ativa, potencial e total.
Acidez Ativa: é definida pela presença de íons livres de
hidrogênio ou dissociados na solução do solo. Normalmente esse hidrogênio livre
é encontrado em concentrações muito baixas. Para melhor expressá-las utiliza-se
do valor pH, como uma maneira mais prática de representá-las. Essa
representação é universal e os valores de pH são obtidos através do logarítimo do inverso da concentração de H+ na solução. A relação que proporciona tal medida
é definida por pH=log(1/{H+}). Por definição, qualquer solução aquosa a 25o
C, tem como resultado do produto da concentração de ânions OH- , pelo
da concentração de cátions H+ o valor de 10-14. Quando uma solução apresenta a concentração de H+ igual à de OH-
, sendo ambas igual a 10-7, ou seja pH=7, ela pode ser considerada uma solução neutra. Assim,
medidas de pH abaixo de 7, indicarão um estado de acidez, com predomínio de cátins H+, enquanto medidas acima
desse valor indicará uma predominância de ânions OH- , definindo um estado de alcalinidade para a
solução.
Acidez Potencial: é representada pela potencialidade do solo em
liberar íons hidrogênio ligados às estruturas moleculares e das quais podem
dissociar-se e passar para a solução. É o fator de resistência às eventuais
perturbações da condição original da acidez do solo.
Acidez Total: é definida pela quantidade resultante do conjunto
dos dois tipos de acidez.
A
acidez consiste num estado de equilíbrio entre a parte do hidrogênio encontrado
na fase líquida do solo (solução) com a parte adsorvida aos colóides (fase
sólida) e envolve aspectos relacionados com a intensidade, com a quantidade e com
a capacidade de sua presença no complexo de trocas, conforme descrito a seguir:
- Uma parte do
hidrogênio existente no solo encontra-se na fase líquida (solução do solo)
e mantém-se em equilíbrio com uma outra encontrada na fase sólida. A sua
concentração efetiva é comumente expressa pelo pH. A atividade ou o nível
de atuação desse hidrogênio na solução do solo, define o fator
intensidade.
- Quando submetido a um
processo de neutralização, o solo tende a liberar quantidades de
hidrogênio de sua fase sólida para a fase líquida, com o objetivo de
retomar o equilíbrio anteriormente existente. A essa quantidade de
hidrogênio disponibilizada dá-se o nome de fator quantidade.
- O solo oferece
resistência sistemática à alterações no
equilíbrio existente. Quando alterações ácidas (fertilizantes) ou básicas
(corretivos) acontecem no solo, este tende a retomar a sua condição
original. Essa resistência à variação de seu pH, conhecida como poder
tampão, constitui-se no fator capacidade da acidez do solo.
|
2.3. Efeitos da Acidez do Solo |
A
acidez do solo atua mais efetivamente de forma indireta sobre o desenvolvimento
das plantas. A sua interferência direta sobre os mecanismos fisiológicos das
plantas é sentida apenas quando a acidez apresenta-se em valores extremos. Na
ausência de situações extremas, a limitação da acidez na sobrevivência das
espécies vegetais, manifesta-se de forma indireta, com a redução ou aumento na
disponibilidade dos nutrientes importantes para a nutrição das plantas.
Nesta
forma indireta, a acidez ao alterar o equilíbrio da disponibilidade de
nutrientes no solo, limita o acesso das plantas a estes elementos químicos ali
existentes. Sem eles as plantas não conseguem exprimir todo o seu potencial de
desenvolvimento. Por outro lado, a mesma condição de acidez que limita o acesso
a esses elementos químicos, pode proporcionar condições para a presença de
níveis elevados de outros elementos que atuam de forma negativa sobre as
plantas. Dentre os elementos, cuja disponibilidade é reduzida quando a solução
do solo apresenta-se com pH baixo (nível elevado de acidez) está o fósforo. Em
situação oposta, o alumínio é o principal elemento com concentração aumentada
nestas mesmas condições de acidez elevada (pH baixo).
Dada
a sua importância na nutrição mineral e a sua pequena mobilidade no solo, a
redução dos teores de fósforo (P) disponíveis, como conseqüência da acidez
elevada, traz como conseqüência limitações no seu caminhamento em direção às
raízes. Como resultado imediato, constata-se que a absorção de P fica limitada,
tendo em vista a pequena quantidade de P liberada em forma absorvível. Nestas
condições, um amplo sistema radicular (algumas vezes limitado pela presença de
Al trocável) pode ajudar para aumentar a captura de fósforo. A absorção de P
aumenta na razão direta do volume de solo ocupado pelas raízes e do nível do
elemento na forma disponível.
Estas
limitações criadas pela acidez do solo reduzem a eficiência dos fertilizantes.
A sua efetividade é estimada pela interferência na quantidade de nutrientes
disponibilizados para as plantas, quando estes são aplicados nos terrenos
cultivados Calcar08a{Ernani(2000a)}. A grande maioria dos nutrientes
torna-se disponível em níveis relativamente bem definidos de pH. Nestas
condições, fica evidente que o suprimento das necessidades das plantas ocorre
mais efetivamente quando a solução do solo encontra-se em uma faixa
relativamente estreita de pH.
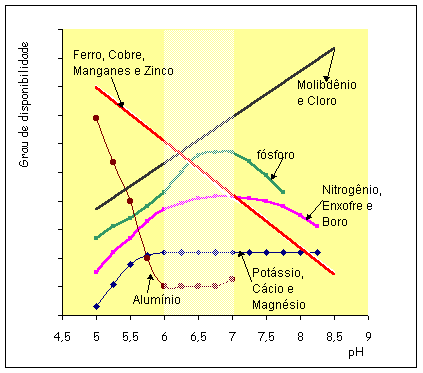
Os
melhores níveis de disponibilidade dos nutrientes na solução do solo acontecem
quando o pH da solução encontra-se entre os valores 5,5 e 7,0 (ver figura 01).
Neste intervalo, são encontradas as condições favoráveis para que a maioria dos
elementos químicos, relacionados com o desenvolvimento das plantas, fique
disponível. Ainda que neste intervalo os nutrientes estejam mais liberados, o
efeito dos mesmos somente será sentido quando os níveis no solo sejam
suficientes para satisfazer as necessidades nutricionais das plantas.
Figura
01. - Influência do pH sobre o comportamento da disponibilidade dos principais
elementos químicos da solução do solo, com importância para o desenvolvimento
das plantas cultivadas.
|
|
Fonte: Calcar07a{Alcarde(1984a)}
Em
um estudo com a cultura do arroz, plantada em diversas amostras de solos de
várzea, cujos valores de pH encontravam-se ao redor de 5,0, a correção da
acidez interferiu pouco na liberação de P natural, mas interferiu de forma
positiva sobre a produção. Contudo, o comportamento da produção, definido pelo
peso de matéria seca, ficou condicionado aos teores originais de P no solo.
Quando os níveis de P no solo apresentavam-se mais elevados a
produção de matéria seca foi maior. Em condição antagônica, os tratamentos
contendo solos com menores teores de P mostraram-se incapazes de suprirem com o
referido nutriente as necessidades fisiológicas da cultura.
A
correlação entre os teores originais de P no solo e a produção de matéria seca
foi altamente positiva. As menores produtividades foram observadas quando os
teores no solo apresentavam-se abaixo de 20ppm (extraído pelo método mehlich-1). Acima deste valor, as plantas apresentaram
significativas melhoras nas produtividades (quadro 1). O trabalho também
evidencia que a elevação dos teores de Ca e Mg no solo, em decorrência dos
níveis aplicados de calcário, não foi suficiente para aumentar a produtividade
da cultura, especialmente onde os teores de P eram mais baixos Adufos18a{Guilherme(1989a)}.
Quadro
1- Comportamento da produtividade de matéria seca e absorção de fósforo pela
cultura de arroz, cultivada em solos de várzea tratados com calcário.
|
Solo no. |
Matéria Seca |
Fósforo Absorvido |
Teor de P no Solo |
|||
|
g/vaso |
mg/vaso |
ppm (чg/cm3) |
||||
|
Com Calcário |
Sem Calcário |
Com Calcário |
Sem Calcário |
Com Calcário |
Sem Calcário |
|
|
1 |
32,27 |
33,30 |
75,14 |
77,51 |
28 |
29 |
|
2 |
39,99 |
39,19 |
102,83 |
103,06 |
54 |
35 |
|
3 |
24,67 |
24,58 |
39,47 |
33,48 |
21 |
20 |
|
4 |
22,27 |
19,84 |
37,14 |
27,68 |
16 |
16 |
|
5 |
43,99 |
35,53 |
117,37 |
108,96 |
56 |
56 |
|
6 |
23,89 |
23,93 |
55,82 |
62,91 |
18 |
17 |
|
7 |
20,10 |
18,11 |
53,62 |
42,98 |
17 |
21 |
Fonte: Guilherme(1989a)
Ao
mesmo tempo, que esse intervalo de pH cria na solução do solo condições
favoráveis para tornar disponíveis os nutrientes necessários para a nutrição
das plantas, oferece como contrapartida condições restritivas para alguns
elementos químicos também muito importantes para o seu crescimento. A parte boa
é que alguns elementos existentes no solo, cuja presença em níveis elevados
poderiam apresentar ação tóxica para os tecidos vegetais também são
neutralizados, deixando o ambiente favorável para as plantas.
A
elevação de pH tende a reduzir as quantidades disponíveis de importantes micronutrientes. Os teores de cobre, ferro, manganês e
zinco têm a suas disponibilidades no solo reduzidas quando o pH dos solos é
elevado de 3 para 8 Calcar23a{OrlandoFilho(1994a)}.
Quando esses elementos, após a aplicação de corretivos, passam a apresentar-se
em baixas concentrações no solo, precisam ter os seus níveis ajustados para as
culturas através da adição dos mesmos ao solo. Para isso são utilizados
fertilizantes como veículo. Essa é uma situação é muito comum em solos
encontrados nos tabuleiros arenosos, com baixa fertilidade, cultivados com
cana-de-açúcar na região nordeste do país. Por outro lado, a redução da acidez,
com a elevação do pH, melhora a disponibilidade de molibdênio e cloro.
Obviamente isto se mostra verdadeiro nos solos onde estes elementos químicos
encontram-se em níveis satisfatórios para suprirem demandas específicas de cada
espécie vegetal. Em condições de níveis insuficientes alterações dos valores de
pH não se mostram com contundência suficiente para liberar estes elementos para
a solução do solo.
Os
teores de alumínio são diminuídos quando a solução encontra-se no intervalo
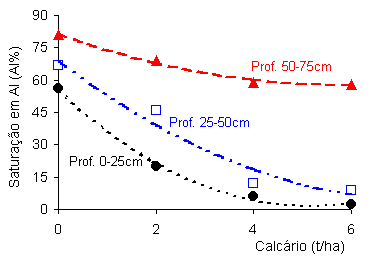
mostrado na figura 1. Trabalhos de campo retratam esta redução de alumínio na medida
em que se eleva o pH do solo. Tal redução pode ser mostrada através da evolução
dos valores saturação de alumínio (m%), quando o solo é submetido a tratamentos
crescentes com corretivos. No quadro 2 são mostradas diferentes profundidades
de amostragem de um solo e os respectivos valores de pH em função de diferentes
quantidades aplicadas de calcário.
Quadro
2- Valores médios de pH, obtidos em três profundidades de amostragem de um solo
arenoso, submetidos a quatro tratamentos com calcário, amostrados 33 meses após
a aplicação do corretivo.
|
Profundidades amostradas do solo |
Calcário (toneladas/ha) |
|||
|
0 |
2 |
4 |
6 |
|
|
0 a 25 cm |
4,74 |
5,52 |
5,80 |
6,20 |
|
25 a 50 cm |
4,78 |
5,32 |
5,93 |
6,15 |
|
50 a 75 cm |
4,54 |
4,64 |
4,66 |
4,70 |
Fonte: Calcar24a{Silva(1991a)}
Estas
alterações do pH do solo mostradas no quadro 2 tiveram efeito direto sobre o
comportamento do alumínio no solo. Com a elevação do pH os valores de saturação
em alumínio (m%) caíram significativamente, mesmo depois de passados quase três
anos de sua aplicação (fig. 02).
Figura
02- Comportamento da saturação de alumínio em um solo arenoso, quando submetido
a diferentes tratamentos com corretivos.
|
|
Fonte: Silva(1991a)
Portanto,
a aplicação de corretivos precisa ser administrada com muito cuidado e critério
para não provocar desordens profundas no equilíbrio dos teores de nutrientes na
solução do solo.
|
2.3. Principais Fontes de Toxicidade |
O
solo em estado de acidez acentuada promove o aparecimento de condições
inóspitas e restritivas para o crescimento das plantas cultivadas. Neste
ambiente o alumínio livre (Al+3) e o
manganês (Mn), este em diversas formas, definidas
pelas suas variadas valências, atuam com grande intensidade, provocando sérias
restrições ao crescimento e desenvolvimento vegetal. Ainda que as plantas
mostrem diferentes graus de tolerância a estas restrições, de uma maneira
geral, recomenda-se que os solos sejam corrigidos, através de agentes
neutralizantes (corretivos), para a sua adequada utilização agrícola. Quando as
condições são desfavoráveis, as restrições manifestam-se como descrito a
seguir.
|
2.3.1. Alumínio |
A
ação tóxica do alumínio pode ser considerada a mais importante limitação
promovida pela acidez dos solos sobre o desenvolvimento das plantas. A presença
do alumínio (Al+3) está sempre associada a presença de íons hidrogênio (H+) na solução do
solo. Assim, o índice de acidez (representado pelo pH) será sempre um fator
indicativo da ocorrência de alumínio livre (Al+3)
na solução do solo. Em condições de abundância de hidrogênio, portanto em
solução ácida, os compostos de alumínio reagem dando origem ao alumínio livre.
Quando o solo é submetido a uma correção, as reações de neutralização tornam o
ambiente alcalino e a reação do alumínio livre com as hidroxilas (OH-),
provenientes da reação do corretivo (CaCO3),
induzem à formação de compostos de menor toxicidade (Al(OH)
3).
No
intervalo de valores de pH entre 5,5 e 7,5 a presença de alumínio solúvel
(livre) é praticamente nula. A maior ou menor quantidade de Al solúvel abaixo
de pH 5,0 será função do tipo de solo e da concentração de estruturas com
cargas disponíveis (eletrólitos). O aumento de compostos com cargas (negativas)
disponíveis tende a aumentar a concentração de Al solúvel no solo numa mesma
faixa de pH.
Nos
solos minerais, com poucas cargas permanentes disponíveis, geralmente a
concentração de alumínio (Al+3) trocável é
baixa. Igual situação pode ser observada em solos arenosos, nos quais a fase
orgânica é responsável pela maior parte do complexo de trocas. Solos turfosos, em cuja composição ocorra pouco ou nenhum
material de origem inorgânica e as cargas do complexo de trocas sejam
dependentes do pH, também poderão apresentar baixas concentrações de alumínio
solúvel. Na outra extremidade da escala, quando os valores de pH encontram-se
acima de 7,5 a 8,0, as concentrações de Al solúvel tornam a elevar-se na
solução do solo.
Os
íons de alumínio livres (Al+3) são
liberados para a solução (fase líquida) ao deixarem a rede cristalina das
argilas (Al2O3) e de outros
componentes sólidos do solo (fase sólida) como o Al(OH)
3. Uma vez na solução do solo e em um nível de significativo de saturação
no complexo de trocas, este íon atuará sobre as atividades funcionais do
sistema radicular. Ao ser absorvido pelo sistema, afeta as atividades
biológicas das raízes. Em elevadas concentrações, acumulam-se nos tecidos,
interferindo no desenvolvimento no das raízes, tornando-as atrofiadas. Como
conseqüência, algumas plantas manifestam pouco desenvolvimento da parte aérea.
Quando
absorvido pela planta, o Al solúvel permanece na zona das raízes, não se
deslocando para as partes superiores das plantas. Em razão disto, as
quantidades observadas nas extremidades superiores (folhas e hastes) não são
sensivelmente maiores que aquelas encontradas em plantas normais, vegetando na
ausência de alumínio.
Por
outro lado, em lavouras cultivadas com espécies tolerantes, crescendo em locais
com a presença de maiores concentrações de alumínio no solo, pode-se
encontrá-lo também com maior acúmulo nas extremidades superiores destas
culturas. Entretanto, em espécies intolerantes o alumínio, quando encontrado no
solo em quantidades acima do suportável, pode trazer pesadas perdas de
produtividade. Em um estudo utilizando-se a planta de algodão como teste,
observou-se uma interferência significativa do alumínio sobre a produção total
de matéria seca (M.S) Calcar06a{Silva(1998a)}. Neste estudo pode-se observar que a
redução do teor de Al no solo através da aplicação de corretivos mostrou uma
correlação positiva com o aumento da produção de matéria seca.
O
efeito danoso do alumínio não fica restrito às ações diretas sobre o
desenvolvimento das raízes. Além de limitar o crescimento das raízes ele pode
estender a sua ação reduzindo as quantidades de P na solução do solo,
interferindo decisivamente sobre o crescimento das plantas como um todo. O
alumínio quando atua de forma indireta pode reagir com o fósforo solúvel,
formando fosfatos de alumínio com baixa solubilidade. Desta forma diminui as
quantidades das formas disponíveis de P na solução do solo, fazendo com que a
sua captura pelas raízes ocorra com maior irregularidade. Reação semelhante
pode ocorrer no interior da planta e afetar a translocação
de P nas plantas.
|
2.3.2. Manganês |
A
forma bivalente de manganês (Mn+2) costuma
ser aquela que se encontra em maior proporção na solução e no complexo de troca
dos solos cultivados. Freqüentemente associado com o alumínio, a disponibilidade deste elemento depende direta e
principalmente do pH da solução, podendo ocorrer em condições de acidez mais
elevadas que aquelas definidas para o alumínio (Al+3).
Ao
tornar-se mais baixo, o pH pode limitar a presença de cálcio no complexo de
trocas do solo e proporcionar condições para intensificar a presença de
manganês, promovendo como conseqüência uma atuação tóxica mais acentuada sobre
as espécies vegetais. À medida que o pH do solo eleva-se, ocorre a diminuição
dos teores da forma bivalente, que são progressivamente transformados em
compostos com maior limitação de solubilidade. Outros fatores adicionais também
podem atuar nesta disponibilidade como os efeitos de oxi-redução
do solo e as atividades microbiológicas do complexo orgânico existente no
terreno.
Quando
encontrado em excesso no solo, pode ser associado a uma limitação na absorção e
transporte de ferro (Fe+2) pela planta.
Quando esta é a condição do solo (presença excessiva de manganês), o sintoma
apresentado por algumas espécies assemelha-se á carência de ferro, com uma clorose internerval das folhas.
Entretanto, a acumulação excessiva de manganês nas plantas pode provocar o
aparecimento de manchas necróticas de coloração parda
nas folhas. O seu excesso no solo pode limitar a atividade biológica de alguns
microorganismos importantes para o desenvolvimento de diversas leguminosas, ao
atuarem no complexo de nodulação das raízes dessas espécies.
Quando
em quantidades adequadas no solo e absorvido de forma a suprir as necessidades
da plantas, o manganês atua como ativador de diversas enzimas, funcionando como
transportador de elétrons na fotossíntese e é fundamental para a formação da
clorofila. Também atua na formação, multiplicação e funcionamento do
cloroplasto.
A
importância deste elemento químico, no processo de síntese das plantas, mostra
o quanto cuidadoso deve ser uso de corretivos na condução de lavouras. Isto
porque, quando o pH do solo apresenta baixos valores o elemento torna-se
tóxico, porém quando o pH eleva-se em demasia o íon passa para formas de pouca
solubilidade, podendo ocorrer a sua falta, o que também poderia ser danoso para
o desenvolvimento vegetativo.
|
3. Neutralização da Acidez dos Solos |
A
acidez do solo, cuja efetividade é representada pelos íons H+
presentes e dispersos na solução do solo, pode ser neutralizada, através da aplicação
de bases fracas como o (CO3-2), encontradas nos
carbonatos e (SiO3-2)
encontradas nos silicatos ou ainda através de bases fortes como OH-,
encontradas nos hidróxidos.
Cada
uma dessas bases apresenta um potencial neutralizante
específico para a redução do hidrogênio livre do solo Calcar15a{Alcarde(1986a)}.
Esse potencial é determinado por constantes de dissociação específicas, no caso
a alcalina (Kb), cujas características são específicas de cada uma dessas
bases. Esses radicais, quando associados ao cálcio e ao magnésio definem os
produtos, que tradicionalmente são caracterizados como corretivos de solos. Ao
reduzirem a quantidade de hidrogênio livre no solo, essas bases tornam o
ambiente mais ajustado para o crescimento das plantas, na medida em que promove
uma maior disponibilidade dos nutrientes na solução do solo (fig. 01).
Os
principais produtos utilizados para a correção da acidez dos solos são
provenientes de fontes naturais de carbonatos e silicatos, produtos
relativamente abundantes na natureza. A neutralização da acidez, é realizada
através de reações destas bases com os íons de H+ presentes na
solução do solo. Esses radicais básicos promovem a redução do hidrogênio e por
extensão do alumínio. Na reação com o primeiro deixa como produto final água e
gás carbônico e na reação com o segundo promove a formação de compostos que são
lixiviados no perfil do solo. Além de funcionarem
como corretivos da acidez dos solos, esses produtos neutralizantes também podem
funcionar como excelentes e pouco custosas fontes para o fornecimento de cálcio
(Ca+2) e magnésio (Mg+2) para
as plantas, em solos com deficiência desses elementos. O sulfato de cálcio
(gesso) apesar de funcionar como uma outra fonte de fornecimento de cálcio, não
atua como corretivo da acidez do solo. Ele exerce a função de corretivo do solo
quando utilizado para corrigir a salinidade e o alumínio existente nas partes
mais profundas dos horizontes explorados pelas raízes das plantas cultivadas FontCorFer15a{Borkert(1987a)}.
Ao possibilitar o aprofundamento do cálcio, dentre outros íons, no perfil do
solo, o gesso promove a precipitação do alumínio através do radical SO4-2.
O fornecimento de gesso cria, desta forma, melhores condições para o
aprofundamento do sistema radicular, possibilitando à planta, explorar um
volume mais significativo de solo.
|
3.1. A Ação da Neutralização |
A
ação neutralizadora da acidez do solo, como visto
anteriormente, é exercida pelo radical básico contido nas principais fontes de
corretivos, caracterizados como constituintes neutralizantes. Dentre eles estão
os radicais CO3-2 e SiO3-2
, que pelo fato de serem bases fracas, possibilitam que suas reações sejam mais
lentas e portanto mais duradouras. Assim, causam baixo impacto sobre as
atividades biológicas do solo. Os óxidos e hidróxidos, ao contrário, reagem com
maior intensidade e rapidez, através do radical básico OH-. Essa
base confere causticidade elevada à solução durante a
sua atuação, promovendo reações com maior intensidade energética. Essa ação
cáustica tem a propriedade de alterar o pH do solo com relativa rapidez. Ao
atuar assim, pode limitar as atividades microbianas no solo, ainda que
temporariamente, em razão da intensidade de sua reação. Eventualmente podem
induzir a uma deficiência, também temporária, de potássio, ao promoverem
a elevação brusca da quantidade de cálcio no solo.
Quanto
à base SO4_2, fornecida pela
dissociação do gesso na solução do solo, pode-se dizer que ela possui ação
fraquíssima na neutralização do hidrogênio. No solo apresenta um efeito mínimo
sobre a acidez. Esse comportamento confere ao gesso a característica de
fertilizante (fonte de cálcio) e não de corretivo de acidez do solo. Ainda que
atue muito levemente nesse sentido, a sua importância reside na eficiência em
deslocar o alumínio para os perfis mais profundos do solo, ao formar complexos
de pouca solubilidade (Al2(SO4)3)
através do radical SO4_2.
|
3.2. Poder de Neutralização |
A
capacidade de reação dos materiais utilizados para a correção da acidez dos
solos pode ser estimada através de determinações químicas, onde é medido o
poder de neutralização do material analisado, além de seus teores de cálcio e
magnésio. Determinar o Poder de Neutralização (PN) de um produto possibilita
conhecer o seu potencial em neutralizar a acidez do solo. A quantificação desse
potencial pode ser obtida fazendo-se reagir uma amostra de um material
corretivo com uma quantidade conhecida e superior à necessária de ácido
clorídrico em solução com concentração 0,5N. A determinação do excesso de ácido
permitirá determinar por diferença qual quantidade do ácido foi neutralizada. O
valor assim determinado definirá qual o Potencial de Neutralização do material
corretivo analisado.
Uma
outra forma de determinar o PN consiste em fazer com que tal avaliação seja
referenciada ao carbonato de cálcio puro (CaCO3),
sendo expressa como equivalente em carbonato de cálcio (ECaCO3),
tomados como índice 100. Assim todas as fontes, inclusive o carbonato de cálcio
impuro (calcários), tem o seu PN referenciados a %E(CaCO3). Essa equivalência pode ser
conseguida através de cálculos utilizando-se as quantidades de óxidos de cálcio
e magnésio e suas respectivas equivalências em CaCO3:
{PN ou %E(CaCO3)=
(%CaOx1,79)+(%MgOx2,48}.
Teoricamente
os valores de PN deveriam ser iguais para os dois tipos de determinação.
Entretanto, as evidências experimentais mostram que os valores determinados
pelo processo analítico e os determinados através de cálculos costumam
apresentar discrepâncias entre eles.
Os
materiais que podem atuar como agentes neutralizantes da acidez dos solos são
diversos. Cada um deles apresenta um potencial específico para a neutralização
do ácido clorídrico utilizado como referência, com o qual são colocados em
contato, para a quantificação de suas capacidades de neutralização de um meio
ácido. Contudo, é importante marcar, que para ser considerado um produto
corretivo de solo, os materiais devem apresentar em sua composição os elementos
cálcio e ou magnésio, macronutrientes importantes para a nutrição e o
desenvolvimento das plantas.
Dessa
forma, ainda que alguns outros produtos contenham em suas composições bases com
características neutralizantes da acidez do solo e efetivamente possam exercer
esse papel quando introduzidas no meio, eles não são considerados corretivos.
Como exemplo podem ser citados os compostos carbonato de sódio (NaCO3), óxido de bário (BaO),
hidróxido de sódio (NaOH) e silicato de bário (BaSiO3).
Nestas
determinações químicas para a caracterização dos produtos neutralizantes as
quantidades de cálcio e magnésio são expressas, por convenção, em CaO e MgO, independente
da origem do produto analisado (calcário, cal virgem, cal hidratada ou
silicatos), enquanto o Poder de Neutralização pode ser expresso em equivalente
percentual de carbonato de cálcio %E(CaCO3).
|
3.3. A Relatividade do Poder de Neutralização |
Para
conhecer-se a efetividade da ação neutralizadora de
um corretivo de solo é importante associar-se o seu poder de neutralização (PN)
com a sua capacidade de reagir com os elementos nocivos do solo.
A
capacidade reação de um corretivo não depende apenas do teor total de
neutralizantes contido no produto utilizado. Além deste conteúdo de material neutralizante, a capacidade de um produto para atuar como
corretivo depende do tamanho das partículas (granulometria) que ele apresenta
quando aplicado ao solo. Essa associação entre o conteúdo do componente neutralizante do corretivo e a composição granulométrica
apresentada por um produto corretivo de solo deu origem ao índice PRNT. Assim,
através de um único indicador, expressando a capacidade relativa do corretivo
de atuar sobre a acidez do solo, tornou-se possível associar o conteúdo de
material neutralizante de um corretivo com as suas
limitações para atuar sobre o meio.
A
interferência da granulometria do produto corretivo é definida através de
legislação específica, onde fica estabelece que 95% do produto moído devem
passar pela peneira de 2mm (ABNT nº 10), 70% deve passar pela peneira de 0,84mm
(ABNT nº 20) e 50% deve passar pela peneira de 0,30mm (ABNT nº 50). Para
calcular-se a taxa reatividade (RE, expressa em %) do produto neutralizante são associadas as diferentes frações
granulométricas, com as respectivas taxas de reatividade de cada um destes
extratos de tamanho de partículas. O cálculo da reatividade (RE) do
produto consiste na multiplicação dos indicadores
de eficiência de cada fração, pela quantidade relativa de cada fração na
amostra analisada. Assim, o material retido na peneira ABNT nº 20, 0,84mm (A1), contribui com 20% de reatividade, o material
retido na peneira ABNT nº 50 (A2), 0,30mm, contribui
com 60% e o material que passou pela peneira ABNT nº 50 (A3)
contribui com 100% de reatividade. Desta forma a eficiência relativa pode ser
calculada pela seguinte relação:
{RE=(0,2xA1)
+ (0,6x A2) + (1xA3)} onde,
(A1) - é igual a quantidade
de material retido na peneira ABNT nº 20, com 0,84mm;
(A2) - é igual quantidade de material retida na
peneira ABNT nº 50, com 0,30mm; e
(A3) - é igual à quantidade de material que passou
pela peneira ABNT nº 50, com 0,30mm, sendo todos estes dados expressos em
valores percentuais (%).
Isolados
esse dois índices (PN e RE) não são suficientes para definir a qualidade de um
produto corretivo. A associação dessas duas medidas de qualidade conduz a um
valor único que confere ao produto corretivo a medida de sua real capacidade
para atuar sobre a acidez do solo. Convencionou-se chamar este indicador de
Poder Relativo de Neutralização Total (PRNT), definido porcentualmente
pela seguinte relação:
{PRNT= (PNxRE)/100} .
Esse índice é de importância fundamental para
a prática da calagem, uma vez que possibilita ajustar a quantidade necessária
de elementos corretivos com a capacidade de reação do produto, definindo o
nível de qualidade apresentada pelos produtos (calcários) disponíveis para
serem utilizados para a adequação da fertilidade dos solos cultivados.
SIGA- Métodos e
Gestão Agrícola S/C Ltda.